近日,中國科學院合肥物質院強磁場中心王俊峰研究員課題組開發了一種膜蛋白表面等離子體共振(Surface Plasmon Resonance,SPR)傳感器芯片表面固定新方法,有效克服了膜蛋白SPR分析中的關鍵技術瓶頸。相關成果發表在國際期刊《分析化學》(Analytical Chemistry)上。
膜蛋白約占人體蛋白質的三分之一,在細胞信號轉導、物質運輸等關鍵生命過程中發揮核心作用,也是藥物研發的主要靶標。據統計,約60%的現代藥物以膜蛋白為作用靶標,例如G蛋白偶聯受體(GPCR)和離子通道等。因此,精確定量表征膜蛋白與蛋白質、小分子藥物等各類配體間的相互作用,對于膜蛋白的功能機制解析以及創新藥物開發至關重要。
SPR是一種基于光學原理的表面分析技術,能夠實時監測生物分子間相互作用,并精確測定其親和力和動力學參數。該技術具有靈敏度高、免標記等優勢,被廣泛應用于生命科學基礎研究和藥物開發等領域。SPR技術被譽為生物分子互作研究的“金標準”, 并已于2016年和2020年分別被列入美國藥典和中國藥典。
盡管SPR技術在可溶性蛋白研究方面已相當成熟,其在膜蛋白領域的應用仍面臨挑戰。主要技術瓶頸在于如何實現膜蛋白在SPR芯片表面的高效、穩定固定,并同時維持其天然構象與生物學活性。
針對該瓶頸,研究團隊創新性地將SpyCatcher-SpyTag共價偶聯系統與膜支架蛋白(MSP)介導的脂質納米盤技術相結合,開發出一種操作簡便、高效穩定的膜蛋白芯片固定新策略。該方法通過柔性鏈接構建MSP-SpyTag融合蛋白,進而利用其將目標膜蛋白組裝至脂質納米盤內;所得的納米盤攜帶SpyTag標簽,能夠與預先通過常規氨基偶聯法固定于CM5芯片表面的SpyCatcher蛋白發生高效、特異的共價結合而被精準捕獲,從而實現膜蛋白在近生理膜環境下的高效、穩定固定。
利用該新方法,研究團隊對三種典型膜蛋白相互作用體系(蛋白-磷脂、跨膜蛋白-抗體、跨膜蛋白-小分子)進行了SPR分析。實驗結果顯示,該方法能夠獲得高質量的SPR數據,成功實現膜蛋白與配體結合的動力學及親和力參數的精確測定。這一新方法有效解決了SPR技術在膜蛋白研究中的關鍵瓶頸,在膜蛋白基礎研究與創新藥物研發領域具有重要應用潛力。
強磁場中心碩士生晏麗為論文第一作者,王俊峰研究員、吳勃副研究員、趙宏鑫副研究員為共同通訊作者。該工作得到了國家重點研發計劃項目、國家自然科學基金項目、安徽省重大基礎研究項目以及強磁場安徽省實驗室的支持。
論文鏈接:https://pubs.acs.org/doi/10.1021/acs.analchem.5c01671
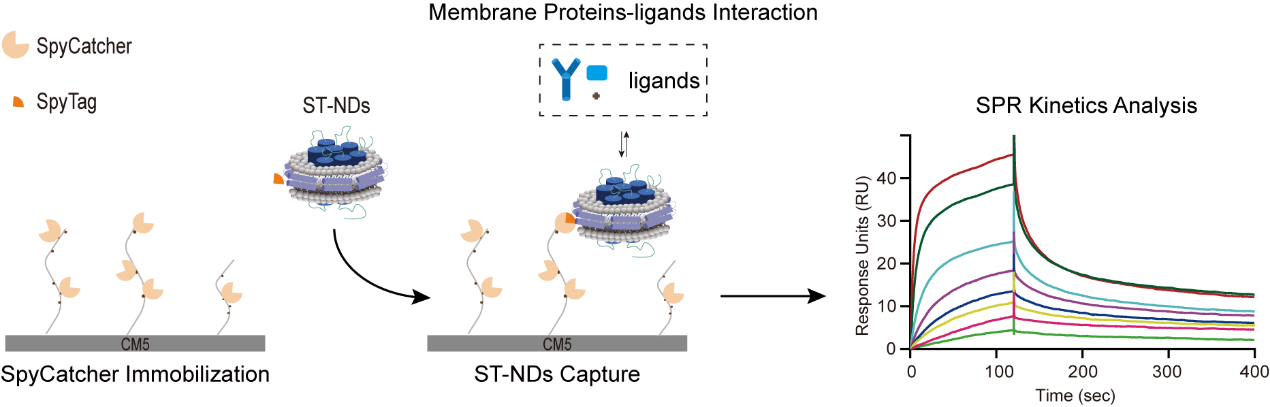
基于SpyCatcher-SpyTag共價反應的膜蛋白芯片表面固定及SPR檢測示意圖

<span id="9mlez"><optgroup id="9mlez"></optgroup></span>