<span id="9mlez"><optgroup id="9mlez"></optgroup></span>
近日,中科院合肥研究院健康所方志友研究員和陳學冉副研究員(中科院青年創新促進會成員)課題組在尋找惡性膠質瘤放射增敏的新靶點方面取得新進展,成果發表在放療紅皮雜志International Journal of Radiation Oncology Biology Physics上。
由于惡性膠質瘤手術存在難以徹底切除病灶、對化療藥物不敏感、放射抗性顯著及缺乏增敏藥物等問題,惡性膠質瘤患者的預后仍然較差,絕大多數腫瘤在放療野內仍會復發和進展。因此,尋找惡性膠質瘤放射增敏的新靶點,進一步提高惡性膠質瘤的放療效果,具有十分重要的臨床意義。
該研究團隊通過對近十年相關文獻檢索以及整理,總共收集402個基因,涉及人類腫瘤輻射敏感調控分子機制。研究發現,由ZDHHC(zinc finger DHHC domain)結構域蛋白家族所介導的棕櫚酰化修飾與惡性膠質瘤細胞的發生、局部的浸潤及預后有著相當密切的關系。進一步研究發現,腫瘤輻射敏感調控因子中有126個基因所編碼的蛋白能夠或具有潛在的棕櫚酰化修飾。其中,輻射敏感調控中處于關鍵位置的SETD2蛋白我們首次通過質譜及生化分析,證實能夠被S-棕櫚酰化修飾。SETD2是一種組蛋白賴氨酸N端甲基化轉移酶,其修飾產物H3K36me3在同源重組修復以及DNA錯配修復中具有重要作用,從而參與基因的調節以及維持基因組穩定性。
本項研究工作在腫瘤治療手段上從輻射增敏、生物學功能上從DNA損傷應答以及分子調控機理上從蛋白翻譯后修飾這一系列研究角度出發,以膠質瘤標本、膠質瘤細胞系及PDX移植瘤模型作為實驗對象,解析了SETD2的S-棕櫚酰修飾在DNA損傷應答及膠質瘤輻射敏感性中的作用,以及靶向小分子化合物的篩選和療效評估。基于此,揭示了SETD2棕櫚酰化分別通過H3H3K36me3-ATM信號及mRNA可變剪切兩個途徑在DNA損傷修復及膠質瘤敏感性中的功能作用,建立膠質瘤中蛋白棕櫚酰化修飾、甲基化修飾、轉錄因子和信號傳導等分子調控網絡,從細胞損傷應答及蛋白翻譯后修飾調控兩方面尋找膠質瘤抵抗治療和患者預后不良的根源,為防治膠質瘤復發和惡化提供新思路。
該研究工作獲得了國家自然科學基金、中科院青促會、合肥物質中心等項目的支持。
文章鏈接 :https://www.sciencedirect.com/science/article/pii/S036030162200164X
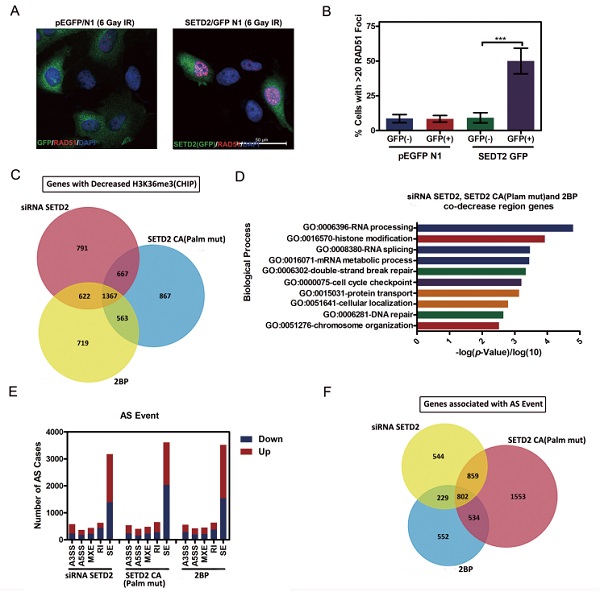
S-棕櫚酰修飾介導SETD2調控的甲基化活性和RNA可變剪切
