近日,穩態強磁場實驗裝置(SHMFF)用戶中國科學技術大學生命科學與醫學部黃成棟教授等團隊,借助SHMFF所屬超導磁體SM3及配套850MHz液體核磁共振(NMR)波譜儀,首次揭示蛋白質中的固有無序區域(IDR)無需與功能結構域直接接觸,即可通過調控構象熵,遠程實現對蛋白活性的“開關”控制,打破了“必須接觸或發生結構變化才能調控”的傳統認知,為新型分子開關的設計提供了全新思路。該研究發表于《自然-結構與分子生物學》(Nature Structural & Molecular Biology)期刊,并同步在該期刊上發表Research Briefing專題解讀。
蛋白質的IDR廣泛存在,卻常因“缺乏穩定結構”而被視作“無用尾巴”。本研究以分子伴侶Sgt2為模型,通過高分辨率NMR和生化主要研究手段研究表明,Sgt2的自抑制作用與蛋白的中間結構域無關,而是由IDR特定的氨基酸序列決定 (圖1);只要改變IDR的序列,這種自抑制效果就會消失。由此表明,IDR區域本身很可能是決定蛋白功能的核心元件,而非“進化殘留”。
與經典的“構象變化”模型不同,該研究證實,Sgt2蛋白的自抑制和解鎖過程完全建立在內部動力學變化(即構象熵)的調節上。IDR存在時,分子整體處于高度動態、低序參數(高熵)狀態,功能域被“鎖定”;而IDR被切除或底物結合后,分子變得剛性,活性被“解鎖” (圖2)。這揭示了“動態熵信號”作為蛋白遠程調控的新范式,有望推廣到更多蛋白系統中。
該工作也充分展現了液體NMR技術在解析蛋白動態與功能關系上的獨特優勢。這一發現不僅拓展了蛋白質調控機制的認知,更為未來開發高效、可控的新型蛋白分子開關提供了理論基礎。
中國科學技術大學博士生季拓為論文第一作者;黃成棟、王育才、王朝教授為共同通訊作者。該項研究工作得到科技部、國家自然科學基金委員會、無膜細胞器與細胞動力學教育部重點實驗室、合肥綜合性國家科學中心大健康研究院等機構資助。
論文鏈接:https://www.nature.com/articles/s41594-025-01585-7
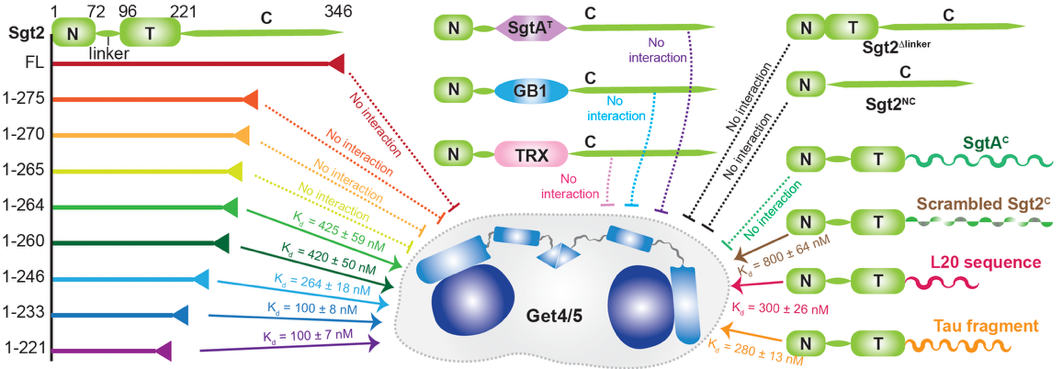
圖1. Sgt2的自抑制作用由C端IDR的特定序列決定,且不依賴中間結構域或其他蛋白片段
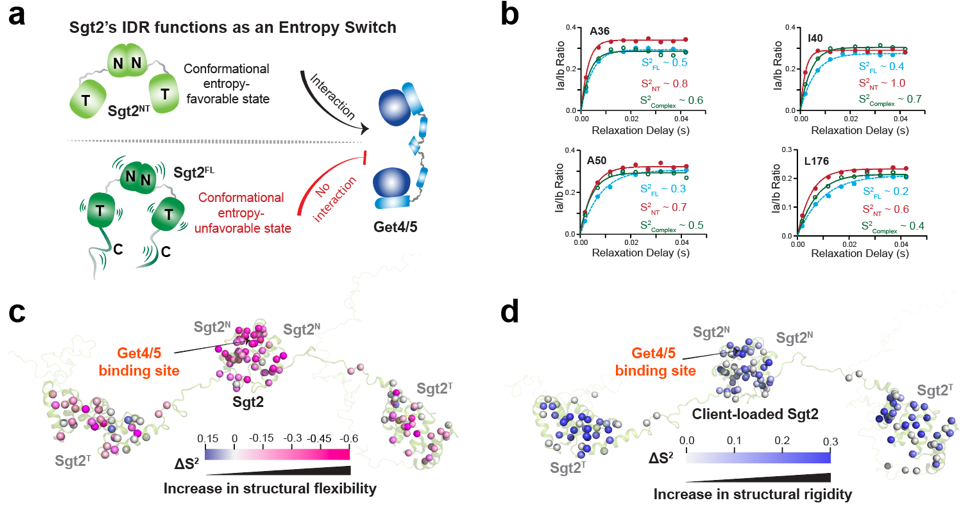
圖2. Sgt2的IDR通過調控分子構象熵,實現了無需直接接觸的遠程自抑制和激活機制,從而動態切換蛋白的結合能力

<span id="9mlez"><optgroup id="9mlez"></optgroup></span>