<span id="9mlez"><optgroup id="9mlez"></optgroup></span>
近期,中科院合肥研究院強磁場科學中心王俊峰課題組在利用液體核磁共振技術研究蛋白質相互作用領域取得進展。該研究揭示了人源Vav2蛋白與細胞膜磷脂以及受體酪氨酸激酶EphA2近膜區的選擇性識別機制,并發現磷脂雙層膜環境對蛋白-蛋白相互作用的影響。相關研究成果以“Biochemical and NMR characterization of the interactions of Vav2-SH2 domain with lipids and the EphA2 juxtamembrane region on membrane”為題發表在國際期刊Biochemical Journal雜志上。
蛋白質在體內通過與其它分子的相互作用發揮功能,包括:蛋白質、磷脂、核酸等。液體核磁共振技術可以在原子層次,近生理條件下研究蛋白質相互作用。Vav2蛋白是Rho家族小GTP酶的鳥苷酸交換因子(GEF),催化Rho GTP酶的活化。Vav2在人體內廣泛分布,參與調控細胞遷移,血管生成,神經發育等重要生理過程。研究表明Vav2可以通過其SH2結構域特異識別Ephrins受體、表皮生長因子受體(EGFR)等多種細胞表面受體的胞內區酪氨酸磷酸化位點,進而被招募到細胞膜上并介導不同細胞信號轉導。
在該項工作中,研究人員揭示了Vav2-SH2結構域能夠利用其傳統的蛋白結合位點與EphA2 近膜區(EphA2-JM)Y594磷酸化位點特異結合。同時,還發現Vav2-SH2不僅可以介導蛋白-蛋白識別,還具有磷脂分子識別功能,能夠特異性識別磷脂PI(4,5)P2和PI(3,4,5)P3。核磁共振實驗確定了其磷脂結合位點,該位點獨立于其蛋白結合位點。進一步,研究人員應用磷脂納米盤(nanodiscs)來模擬細胞磷脂雙層膜,研究了Vav2-SH2與膜錨定的EphA2 近膜區的相互作用,發現膜環境提高了Vav2-SH2與EphA2-JM的結合親和力,表明了生物膜調控蛋白-蛋白相互作用的重要性。該研究為在近生理條件下,磷脂雙層膜環境中研究蛋白-蛋白相互作用提供了一種思路。
該項研究獲得國家自然科學基金和國家重點研發項目的支持。所有核磁共振實驗均在穩態強磁場實驗裝置的核磁共振譜儀系統上完成。
文章鏈接:https://portlandpress.com/biochemj/article/477/19/3791/226367/
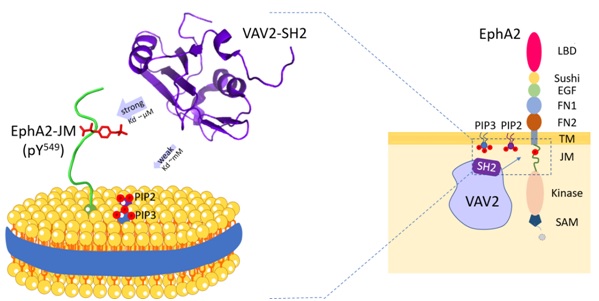
Vav2-SH2 蛋白與磷脂及EphA2-JM結合的示意圖
