<span id="9mlez"><optgroup id="9mlez"></optgroup></span>
近期,中科院合肥研究院醫學物理與技術中心輻射生物醫學研究室韓偉團隊在低溫等離子體腫瘤治療方面再次取得重要突破,首次報導大氣壓低溫等離子體可有效誘導腫瘤細胞發生焦亡(Pyroptosis)。相關論文“Cold Atmospheric Plasma Induces GSDME-Dependent Pyroptotic Signaling Pathway via ROS Generation in Tumor Cells”發表于Cell Death & Disease上。該期刊系Nature出版集團旗下的醫學生命科學期刊之一,主要關注細胞死亡和轉化醫學研究等領域的原創性研究。
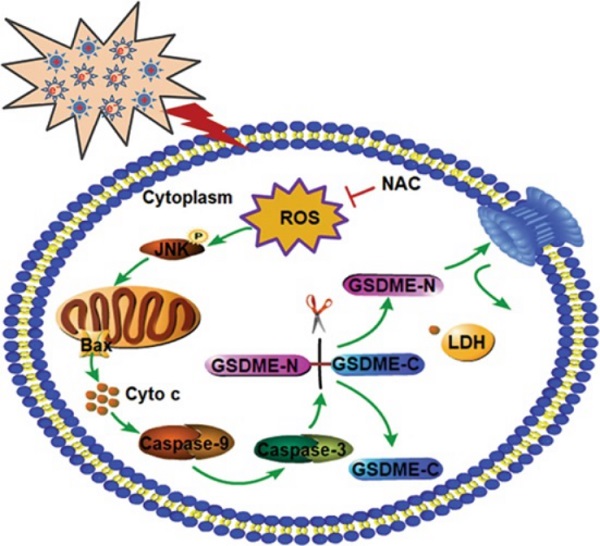
等離子體醫學近年來蓬勃發展,等離子體腫瘤治療被視為一種新興的腫瘤治療方式。以往大量研究表明,等離子體通過誘導腫瘤細胞發生典型凋亡或壞死等形式的細胞死亡,達到抑制腫瘤生長及“清除”腫瘤的效果。細胞焦亡是一種炎性細胞程序性死亡,以往細胞焦亡研究多集中于機體固有免疫。2017年,邵峰院士首次發現化療藥物可導致腫瘤細胞發生GSDME介導的焦亡,不同于凋亡,腫瘤細胞的焦亡發生更為快速,容易激活體內免疫系統。
該研究通過篩查三個瘤種共計十五株腫瘤細胞系,發現等離子體對腫瘤細胞的殺傷效果與細胞內GSDME的表達水平呈正相關;相關分子機制研究表明,等離子體通過激活ROS/JNK/Cytochrome C/Caspse-9/Caspse-3信號通路,進一步切割GSDME,導致腫瘤細胞發生焦亡型細胞死亡。
該研究不僅首次報導了等離子體致死腫瘤細胞的新型死亡方式——焦亡,也是首次報導物理治療方法可導致腫瘤細胞發生焦亡。研究結果進一步增加了對等離子體腫瘤治療機制的深入了解,為凋亡抵抗型腫瘤提供了一種新的治療策略。
該研究工作由輻射生物醫學研究室楊小枘和陳國棟共同完成。研究得到國家重點研發計劃、安徽省自然科學基金資助。
文章鏈接:https://www.nature.com/articles/s41419-020-2459-3