<span id="9mlez"><optgroup id="9mlez"></optgroup></span>
近期,中科院合肥研究院強磁場中心趙國平課題組在腫瘤放療敏感性研究中取得重要進展,相關研究成果發表在國際期刊Cell death & disease上。該研究發現內質網駐留蛋白PDI在輻射刺激下轉位至線粒體,參與調控線粒體自噬并介導腫瘤放療敏感性,這對解析線粒體靶在輻射敏感性中的作用具有重要意義。
線粒體自噬(Mitophagy)是一種選擇性清除受損線粒體的特異性自噬現象。放射治療誘導線粒體損傷,擾亂線粒體功能,導致有缺陷的細胞器逐漸積累,適度的線粒體自噬能夠促進細胞穩態,但過度的自噬反而會加速誘導細胞走向死亡。蛋白質二硫鍵異構酶(PDI)是一種介導二硫鍵形成的內質網(ER)酶,在癌癥的發生發展及治療過程中具有重要作用,PDI在腫瘤組織中的高表達通常伴隨著腫瘤病理等級的增加。課題組之前的研究發現,PDI可以通過誘導線粒體功能障礙介導細胞凋亡信號。本研究在前期研究基礎上進一步發現PDI可通過調節線粒體自噬信號抑制放療誘導的細胞死亡。
本研究中,通過臨床腫瘤樣本病理學分析及生物信息學分析,科研人員發現PDI在結直腸癌(CRC)等腫瘤中的高表達顯著增加癌癥患者的轉移風險和不良預后。機制上發現輻射誘導內質網應激(ERS)后,PDI和GRP78的結合增強,進而抑制GRP78降解AKT,并最終激活mTOR通路以抑制自噬啟動。通過進一步研究發現,PDI可以直接與線粒體自噬受體PHB2相互作用,從而競爭性地阻斷LC3Ⅱ與PHB2的結合,抑制線粒體自噬信號傳導。以上結果表明PDI可以通過調節線粒體自噬來降低放療敏感性,明確了PDI在輻射誘導的細胞自噬中的新功能。該工作為理解線粒體靶調控腫瘤放療敏感性提供新見解,并為使用PDI抑制劑應用于臨床腫瘤放療提供了基本原理。
本研究工作得到了國家自然科學基金、合肥研究院院長基金、安徽省重點研發計劃等項目的資助和支持。
文章鏈接:https://doi.org/10.1038/s41419-022-05302-w
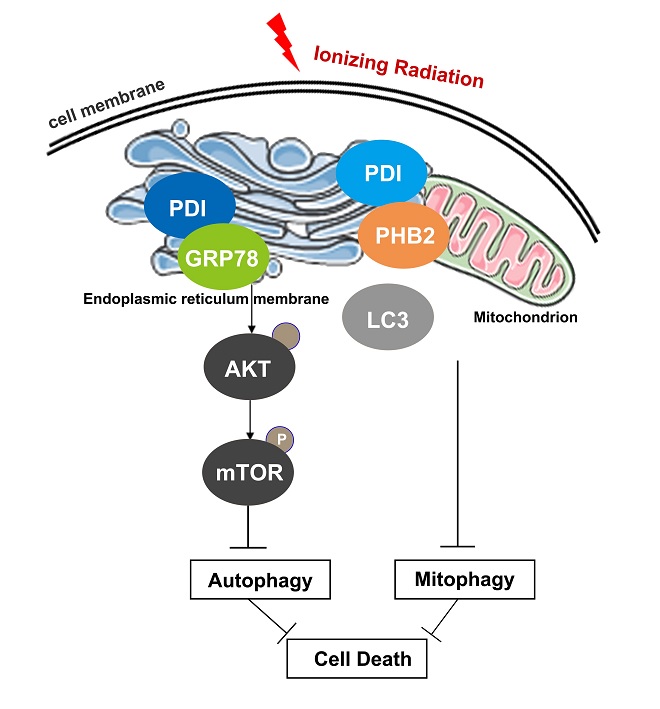
PDI調節細胞自噬作用的示意圖
