<span id="9mlez"><optgroup id="9mlez"></optgroup></span>
近期,中科院合肥研究院強磁場科學中心王俊峰研究員課題組在深入理解生物礦化蛋白調控納米晶體分子機制基礎上,綜合了無機納米載體和蛋白質載體這兩種重要藥物遞送系統的優點,成功設計合成安全且高效的納米魚雷狀的新型化療藥物遞送平臺,相關成果發表在國際期刊Chemical Engineering Journal上。
安全且高效的化療藥物遞送系統可以有效延長藥物的半衰期,提高藥效,減少其毒副作用。近年來,基于脂質體藥物載體開發的化療藥物如Doxil(阿霉素脂質體)和Onivyd(伊立替康脂質體)已廣泛應用于臨床。但是由于脂質體類藥物載體結構組裝松散,穩定性較差,化療藥物在血液循環中十分容易泄漏,不僅導致病變區域的蓄積量低,而且潛在的心臟毒性風險高。隨著納米技術的快速發展,基于無機納米顆粒的開發化療藥物載體可以有效地穩定化療藥物,提高載藥效率,延長血液循環中的半衰期并且可以賦予藥物綜合診斷和治療的能力。另外,基于蛋白質的開發化療藥物載體具有良好的生物相容性和生物降解性,易于修飾,可提高藥物穩定性,降低或消除免疫原性和副作用。然而,這兩種遞送系統仍有其自身的局限性,主要表現為無機納米顆粒的生物毒性和蛋白質載體的載藥效率較低。因此,同時結合無機納米顆粒和蛋白質載體的優勢是一個重要策略來優化藥物輸送系統。
受生物礦化過程的啟發,利用生物大分子(蛋白質)進行仿生合成已成為構建具有高生物相容性和穩定性的有機-無機復合材料的重要方法。基于此前課題組相關研究的基礎(Journal of Materials Chemistry B, 2017, 5(16): 2888-2895;ACS Applied Materials & Interfaces, 2020, 12(51): 56701-56711;PNAS,2022,Vol. 119 No. 45),團隊成功地利用礦化BSA蛋白仿生合成體系實現無機納米與蛋白有機結合,構建出白蛋白-磁鐵礦納米魚雷藥物載體,實現了疏水化療藥物阿霉素的高效裝載。新型納米魚雷藥物載體由白蛋白與四氧化三鐵組成,具有極佳的生物兼容性,可以被生物體高效吸收和降解。多項的體外與體內實驗數據表明新型載體兼顧了無機納米和蛋白載體的優勢,有效地解決了疏水性小分子化療藥物的泄露問題,延長了血液循環中的半衰期,完成了藥物高效定點胞內運送和腫瘤抑制。除此以外,基于透射電鏡、分子動力學模擬和計算模型,團隊提出了蛋白質-藥物-納米顆粒復合納米魚雷的復雜分子結構。研究結果證實了阿霉素(Dox)包封穩定性的結構基礎,揭示了納米魚雷作為藥物載體的構效關系,拓展了藥物傳遞系統的研究范圍。
強磁場中心博士生趙享龍和博士后許帥為該論文的共同第一作者,強磁場中心王俊峰研究員和馬坤助理研究員為文章的通訊作者。該項研究獲得國家自然科學基金、科技部重大專項、中科院合肥研究院院長基金以及國家重大科技基礎設施“穩態強磁場實驗裝置”(SHMFF)的支持。
文章鏈接:https://doi.org/10.1016/j.cej.2022.140440
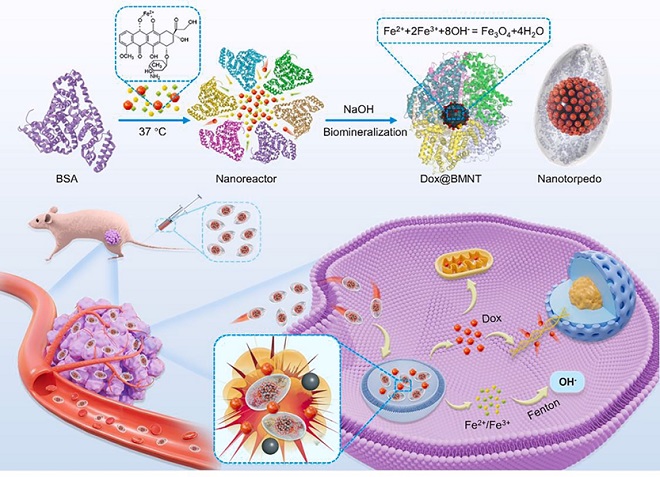
圖.新型納米魚雷藥物遞送平臺具有極高生物兼容性和結構穩定性有效提高藥物裝載效率與藥效
